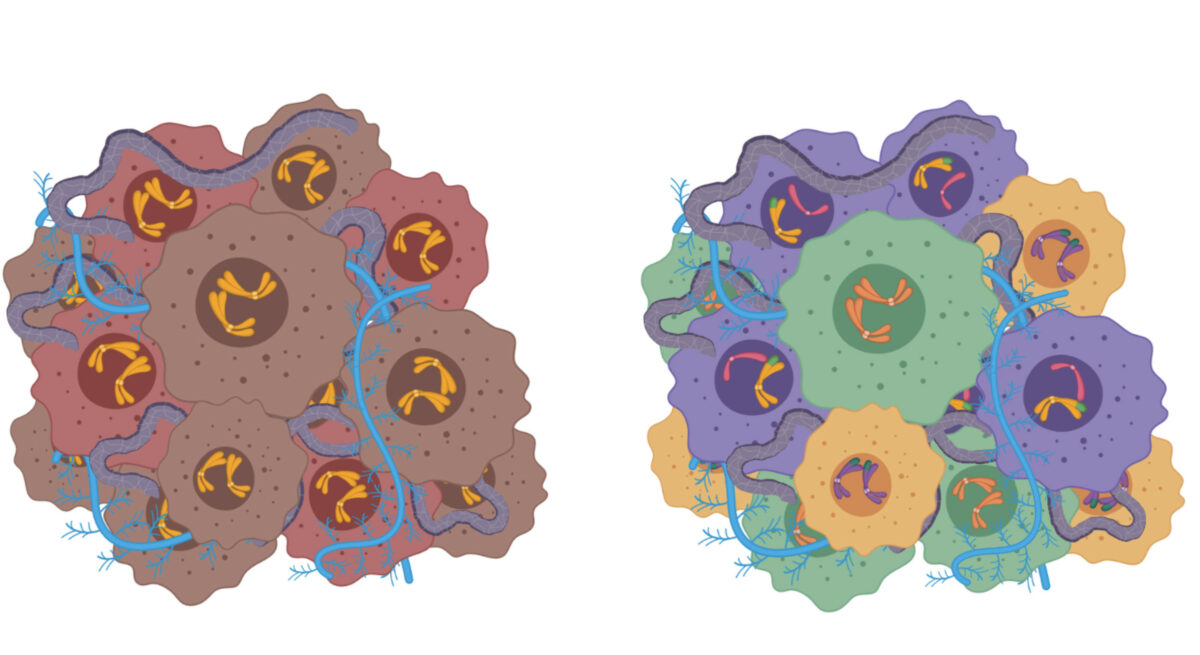
Esquema
Tumor izquierda: No heterogeneidad genética intratumoral; tumor derecha: Sí heterogeneidad intratumoral.
València, 21 de diciembre de 2021. El Instituto de Investigación Sanitaria INCLIVA, del Hospital Clínico de Valencia, ha desarrollado un estudio que analiza la relación entre la heterogeneidad genética intratumoral y la agresividad del neuroblastoma. La investigación, cuyos resultados se han publicado recientemente en Cancers, bajo el título ‘Intra-Tumour Genetic Heterogeneity and Prognosis in High-Risk Neuroblastoma’ tiene como investigadora principal a la Dra. Rosa Noguera, coordinadora, junto con el Dr. Samuel Navarro, del Grupo de Investigación Traslacional de Tumores Sólidos Pediátricos de INCLIVA, y ambos investigadores del CIBER de Cáncer (CIBERONC). En el estudio han participado, además la doctora Amparo López-Carrasco y Susana Martín-Vañó, investigadoras del mismo grupo de INCLIVA y CIBERONC, así como las investigadoras Dra. Ana P. Berbegall, y Maite Blanquer-Maceiras, investigadoras que pertenecieron al mismo grupo de INCLIVA; y la Dra. Victoria Castel, del Grupo de Investigación en Oncología Clínica y Traslacional del Instituto de Investigación La Fe.
El neuroblastoma es un tipo muy raro de cáncer que casi siempre se desarrolla en la infancia y aparece durante los primeros cinco años de vida, sobre todo en lactantes. Representa del 7% al 10% de los cánceres infantiles y, en nuestro país, afecta a unos cien niños al año. Es un cáncer del sistema nervioso simpático, que se localiza frecuentemente en la glándula suprarrenal y puede ser un hallazgo casual en las revisiones pediátricas.
Se estima que aproximadamente el 40% de los niños con neuroblastomas de alto riesgo fallecen, lo que hace necesario obtener más datos traslacionales o ventajas diagnósticas de sus masas tumorales biopsiadas. En estos niños, el tumor no puede ser extraído quirúrgicamente de manera completa ya que suele estar expandido por su cuerpo. Un niño con un neuroblastoma de alto riesgo necesita tratamientos largos y agresivos, que incluyen operar para extraer el tumor, radioterapia, quimioterapia, trasplante de células madre e inmunoterapia.
Los objetivos de este trabajo eran básicamente tres: encontrar la existencia de diferentes clones celulares o células que sean idénticas a una célula predecesora única con cambios cromosómicos concretos (heterogeneidad genética intratumoral) en las muestras de tumores neuroblásticos agresivos (HR-NB siglas en ingles de Neuroblastoma de Alto Riesgo); relacionar la existencia de multiclonalidad o heterogeneidad genética intratumoral con la agresividad clínica tumoral; y describir el método a utilizar en la clínica diaria para su detección.
El papel de la heterogeneidad genética intratumoral en el pronóstico del paciente HR-NB está poco estudiado. Esta se define por las variaciones genómicas y biológicas dentro de un tumor adquirido por la evolución de las células tumorales en diversos microambientes. En este trabajo -que se ha desarrollado desde enero de 2018 hasta mediados del pasado mes de octubre- se buscaban las alteraciones cromosómicas en, al menos, dos áreas diferentes de cada tumor y/o en biopsias sólidas y líquidas (sangre) obtenidas simultáneamente.
Curiosamente, se constató que los pacientes con heterogeneidad genética intratumoral (40% de los casos) tenían una tasa de supervivencia significativamente mejor que aquellos con tumores no heterogéneos, especialmente en los casos sin amplificación de oncogén MYCN. Además, todos los pacientes de la cohorte estudiada con heterogeneidad genética intratumoral elevada (definida como 50% o más diferencias genéticas entre áreas de un mismo tumor o muestras obtenidas simultáneamente) sobrevivieron después de 48 meses. Estos resultados respaldan claramente el análisis de al menos dos áreas de tumores sólidos (por separado o mezcladas) y biopsias líquidas para proporcionar opciones de diagnóstico, pronóstico y terapia genómicos más precisas en HR-NB.
Se aplicaron técnicas pangenómicas (HD-SNPa) e hibridación in situ fluorescente (FISH) para detectar el perfil pangenómico en más de 1 fragmento tumoral y biopsia líquida (129 muestras de 58 pacientes HR-NB). Todas las muestras se enviaron al Centro Español de Referencia de Estudios Genéticos y Anatomopatológicos de NB (Departamento de Patología, Universidad de Valencia-INCLIVA). Los datos histopatológicos fueron proporcionados por el patólogo del grupo. Los datos clínicos fueron proporcionados por el oncólogo pediatra del hospital de origen cuando fue posible, o por el Centro de Referencia de Estudios Clínicos de NB (Hospital Universitario La Fe, València).
Las muestras utilizadas en el estudio -aprobado por el Comité Ético de Investigación Clínica (CEIC) de INCLIVA- estaban almacenadas en la Colección de Tumores Neuroblásticos del Registro Nacional de Biobancos del ICIII de INCLIVA. Se utilizaron, además, la plataforma de biopsia líquida de INCLIVA y plataformas y equipamientos del Laboratorio de Patología Molecular y UCIM de la Facultad de Medicina de València.
Este estudio fue apoyado por ISCIII (FIS) y FEDER (Fondo Europeo de Desarrollo Regional): PI17 / 01558 y PI20 / 01107 (material fungible), CIBERONC (CB16 / 12/00484; financiación salario 2 investigadoras posdoctorales), Asociación NEN (Nico contra el cáncer infantil 2017-PVR00157; salario 2 investigadoras predoctorales y material fungible) y Fundación Científica de la Asociación Española contra el Cáncer (FAECC2015 / 006; material fungible).
Link del artículo: https://www.mdpi.com/2072-6694/13/20/5173/pdf